振とう培養 リアルタイムモニタリングシステム SFR vario

- 概要
- 特徴
- 仕様
- 導入事例事例
測定原理
PreSens社製 非破壊酸素計/pH計 は、センサースポットと呼ばれる 酸素, 水素イオンに感度を持つ蛍光染料フィルム(酸素,pHセンサー)から発せられる、蛍光エネルギを測定するという光学的手法を利用しています。
フラスコ下のSFR vario からの励起光により、フラスコ内の酸素あるいは水素イオン濃度に依存してチップが蛍光を発します。この蛍光時間を非侵襲的に読み取ります。蛍光時間は酸素あるいは水素イオンにのみ依存します。
使用事例
微生物培養,CHO 細胞等培養時の酸素, pH, OUR, バイオマス測定による活性モニタリング
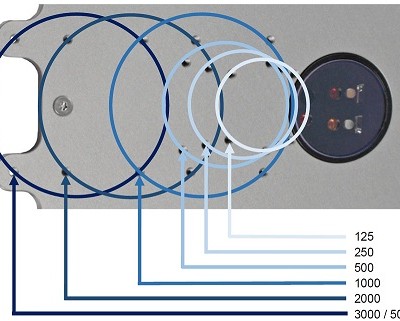
SFR varioは1台の振とうフラスコで酸素, pH, OUR, バイオマス(濁度)を非接触で測定できます。
一般的な振とう機に設置できるSFRシリーズはバッテリー内蔵で、Bluetoothでワイヤレスで測定データを送信できます。
酸素, pHはフラスコの底から非接触で読み取ります。
使い捨てのプラスチックフラスコは酸素センサーとpHセンサー搭載。校正されており、放射線滅菌されています。
グラスフラスコはオートクレーブ可能な酸素センサーと一回オートクレーブでき取り外し可能なpHセンサーが搭載されています。
関連ページ
- 特徴
特徴
● 溶存酸素、pH、バイオマス(OD)の測定が可能
● 酸素電極と異なり、測定で酸素を消費しません
● クイック・レスポンス & ロー・コスト (測定試薬等が不要)
● リアルタイム培養モニタリング
● ワイヤレスデータ収集でコンタミリスクを低減
● 各種センサーフラスコをご用意
● ID管理により長期モニタリングとデータ管理が可能
● 同時、複数台制御機能を持つデータベースソフトでの簡単測定
- 仕様
- 導入事例
微生物の成長プロファイルの特徴付け
振とうフラスコは、プロセスと培地の最適化、新製品と菌株のスクリーニング、バイオリアクター培養用の接種材料の供給に最もよく使用される培養システムです。酸素制限は主要なものの1つですが、好気性の振とうフラスコ培養ではしばしば問題が無視されます。SFRシェイクフラスコリーダーの新技術は、2つの培養パラメーターである酸素とpHを非侵襲的に監視するための理想的なツールであり、さらに成長のパフォーマンスとプロファイルの詳細な画像を明らかにします。
再現性のある好気性栽培を確実にするには、中枢代謝に大きな変化をもたらす酸素制限を回避する必要があります。同様にpHの変化も細胞の代謝に影響します。振とうフラスコ内の酸素移動を特徴付けるために一連の研究が行われましたが、さまざまな要因により、予測が非常に難しい酸素の物質移動が変化します。これらの中には、通常手作りのバッフルの形状と表面活性化合物の製造があります。溶存酸素濃度(DO)とpHのオンライン監視も、振とうフラスコでこれらの一般的に重要なパラメーターの制御を可能にします。調査にはSFR(www.presens.de/SFR)を使用します。
大腸菌培養中の再現性試験
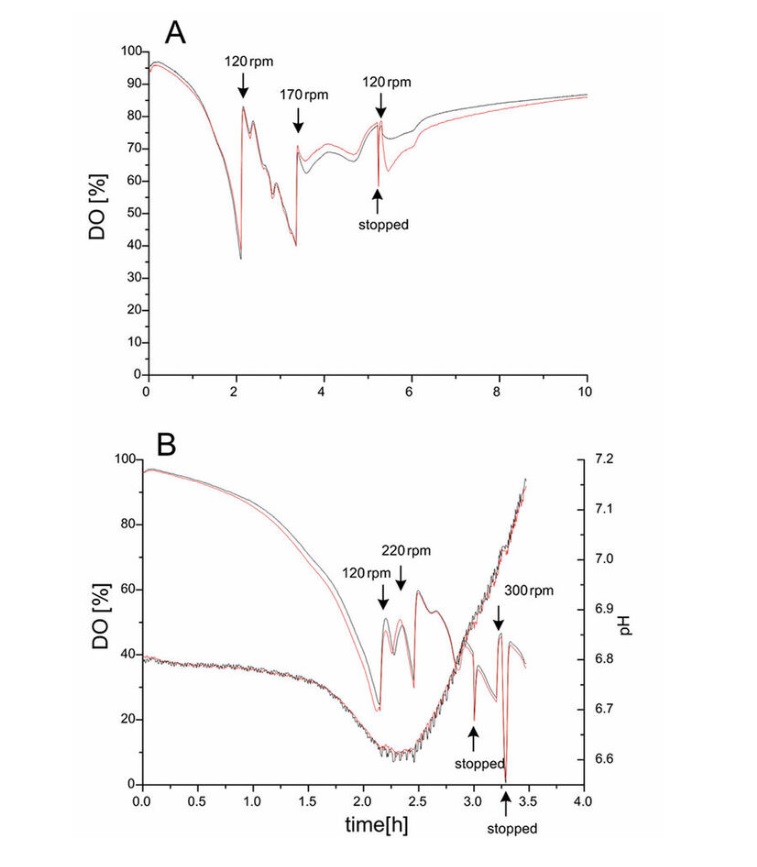
光センサー測定システムの再現性をテストするために、大腸菌を、酸素センサーを備えたバッフルガラスと非バッフルプラスチックシェークフラスコで培養し、プラスチックフラスコの場合は、追加のpHセンサーで培養しました。どちらの場合も、k L aの値が似ている振とうフラスコを選択しました。培養は、37°Cで、90 rpmの初期振とう頻度で2回ずつ行いました。大腸菌の栽培中バッフル付きガラス振とうフラスコのDH5aは、光学密度(OD 600 nm)0.1で接種した後、DOの加速的な低下を観察できました(図1A)。培養の2時間後、培養の酸素制限を回避するために、振とう速度を120 rpmに上げました。5.5時間後、振とう速度を170rpmまでもう一度上げました。最初の部分では0から2時間の範囲で指数関数的成長が観察され、その後に使用済みのLB培地で利用可能なさまざまな基質が消費される第2フェーズが続きます。細胞代謝の再編成は2〜5時間で観察でき、DO濃度はいくつかの明確なピークを示した。5時間後、振とう頻度は120rpmにリセットされました。培養の呼吸活動が徐々に減少するため、DOはゆっくりと増加しました。DOおよびpHのプロファイルバッフルなしの振とうフラスコでの大腸菌 DH5a培養を図1Bに示します。これらのフラスコは、酸素供給が不十分であったため、急速に成長する大腸菌の好気性培養にはあまり適していなかったことは明らかです。
図1:酸素センサーを備えた250 mlのバフフェルドガラス振とうフラスコでのLB複合培地での大腸菌 DH5aの2つのバッチ培養のDOおよびpHの時間経過(A)。酸素およびpHセンサーを備えた250 mlのバッフルのないプラスチック振とうフラスコ。培養は37°Cで、最初は90 rpmの振とう回数で行いました(B)。振動速度の変化は矢印で示されています。重複が表示されます。
C. glutamicumの培養中の代謝イベント
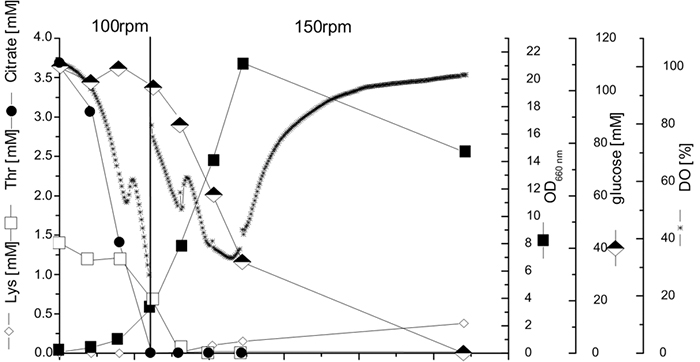
C. glutamicumの培養は、酸素センサーを備えたバッフル付き250 ml振とうフラスコ内で、30°Cで100 rpmの振とう回数で行いました。複製からの平均値を図2に示します。酸素消費、成長、グルコース、スレオニン、クエン酸塩の取り込み、およびリジンの生産を監視しました(図2)。測定の再現性の調査のために、同様のk Lの振とうフラスコ値は並行実験に使用されました。結果として得られたDOの標準偏差は3%未満であり、培養と測定の再現性が高いことを示しています。栽培は、まず主にクエン酸塩を消費し、次に主要な炭素源としてグルコースを消費する、二相性の成長挙動を伴う典型的な二相プロファイルを示しました。炭素源としてのクエン酸塩からグルコースへの代謝のシフトは、DO濃度の短い増加を使用して正確に決定できます。5.5時間後、酸素要求量が高いため、振とう頻度は150 rpmに再び増加しました。
図2:限定培地でのバッチ培養におけるC. glutamicum ATCC 13032の培養プロファイル。培養は、酸素センサーを備えた250 mlのバッフル付きガラス振とうフラスコ内で、それぞれ30°Cおよび100/150 rpmで示されているように行われました。重複からの平均値が表示されます。
オンラインpH測定を使用したバッファー要件の最小化
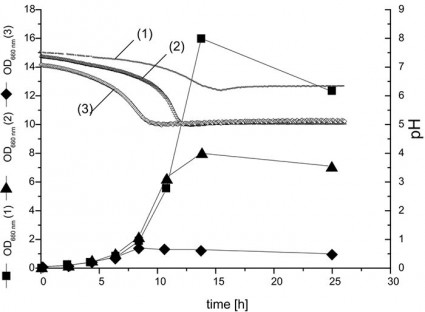
培地の最適化中、特に工業生産では、生物の最小バッファー要件を決定することが必須です。例として、C. glutamicum lysC fbrは、異なる濃度のリン酸緩衝液を含む規定の培地で増殖させ、pHをオンラインで監視しました。培養は、pHおよび酸素センサーを備えた250 mlの邪魔にならないプラスチック振とうフラスコを使用して行った。培養プロファイルを図3に示します。図3のODおよびDOコースが示すように、32 mMおよび6 mMのリン酸塩濃度は明らかに制限されていました。
図3:異なる濃度のリン酸バッファー106 mM(1)、32 mM(2)および6 mM(3)を含む定義培地でのバッチ培養におけるC. glutamicum lysCfbrの培養。培養は、酸素およびpHセンサーを備えた250 mlのバッフルなしのプラスチック振とうフラスコで30°C、230 rpmで行いました。
結論
新しいSFRシステムは、振とうフラスコ培養におけるDOおよびpHの正確な測定を提供するため、培養の品質と信頼性を大幅に向上させます。測定データはオンラインで入手できるため、空気、酸素、窒素の混合ガスを使用してDOを制御できます。pHは、アルカリまたは酸の自動添加により制御できます。k Lの場合aが決定されると、酸素摂取率は栽培中にオンラインで決定されます。大きな利点は、培養の基質または酸素制限を即座に視覚化できることです。これは、好気性プロセスのスクリーニング装置として振とうフラスコを使用する場合の重要な要素です。DO測定は、二相性効果のオンライン表示も提供します。DOのオンライン監視はもちろん、振とうフラスコで観察される酸素移動の制限を取り除きませんが、酸素が制限されているかどうかの制御を可能にします。システム生物学の多くの定量的研究は、バイオリアクターの代わりに振とうフラスコで行われます。振とうフラスコは通常、攪拌バイオリアクターよりも酸素移動率が低いため、例えば、中のDO濃度を監視することはさらに重要です。
Schneider et al。、2009、振とうフラスコ培養における溶存酸素とpHの並行オンライン測定用の光学装置を応用したアプリケーションノート。バイオプロセスBiosyst Eng DOI 10.1007 / s00449-009-0367-0
CHO細胞培養におけるプロセスモニタリング
振とうバイオリアクターにおける溶存酸素濃度およびpHのオンライン測定は、
ベンチトップ攪拌タンクから小スケールへスケールダウンへの最適化に貢献します。
溶存酸素の改善のための振とう速度の調整は、
高い細胞密度で起こり得る酸素制限を回避することが可能です。
インキュベータ内のpCO2を調整することによる簡単なpH再調整は、
振とうバイオリアクターを用いた簡単な実験からのスループットを最適化することが可能です。
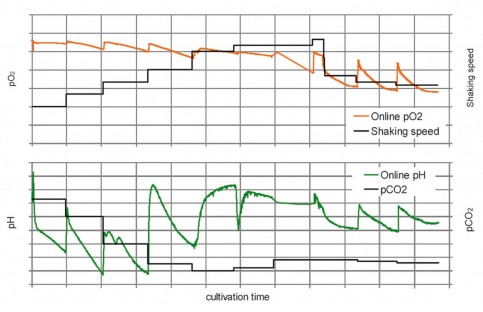
大腸菌の生育中のバイオマス、O 2およびpHモニタリング
大腸菌 K12は、グルコースおよびラクトースを含む培地中で明確なジアジック成長を示し、
これはSFR varioでモニターすることができます。
オフラインサンプリング(基質濃度を決定する)のために測定を数回停止し、
グラフのギャップを示しました。
第1の成長段階では、グルコースが消費されます(1)。
このシステムは、低バイオマスの精度が低いですが、
これは細胞密度の増加とともに改善します。
細菌によって産生される酢酸は培地のpHを低下させますが、
高い代謝活性を示すように10%までの酸素濃度の強い低下が起こります。
グルコース濃度が0.1g L -1を下回ると約6時間後に成長は停止し、
酸素レベルは急速に上昇します。
これはまた、オンラインで測定されたバイオマス曲線(2)の小さなプラトー(拡大されたインサート)にも示されます。
この段階の間に、細菌はその代謝をラクトースに変更します。
この正確な同期を酸素消費と成長停止に関連づけることは、
SFR varioでのみ実現することができました。
第3段階では、定常期に変わるまで乳糖代謝で増殖します(3)。
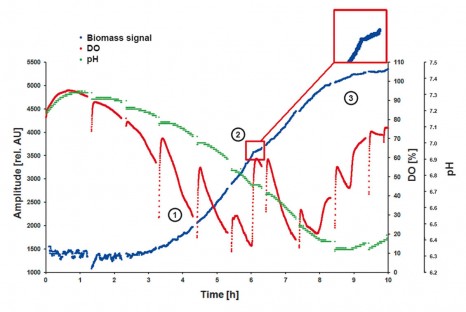
複合培地中の酵母増殖期
K. marxianusは、基質としてグルコースを含む振とうフラスコで培養すると2つの増殖期を示します。
第1相では、グルコースはエアロブ条件下で代謝され(1)、酸素含量は5%未満で連続的に減少します。
代謝産物のために、pH値は7から6.1に低下します。
9時間の培養期間後、グルコースは完全に消費され、pHは再び上昇します。
2番目の酸素制限期にK. marxianusは高酸素要求下で第1段階で生成されたグルコース生成物を代謝する一方で、
散乱光(=バイオマス)測定(2)においてはっきりと観察され得る著しく遅い増殖を示します。
SFR varioを用いた酸素、pHおよびバイオマス(濁度)の同時モニタリングは、
培養モニタリングおよび代謝過程の評価のための全く新しい可能性を提供します。
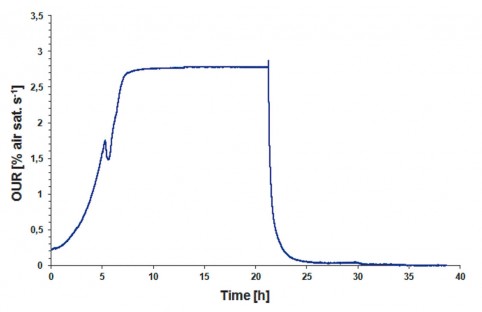
酸素摂取量の測定
微生物の酸素摂取速度を測定することは、代謝活性の非常に良い指標であり、代謝プロセスが起こる速度を評価したり成長状態を予測するために使用することができます。
左のグラフはS. cerevisiaeの OURを示す振とうフラスコ培養中のYPD培地中で培養しました。
酸素摂取率は、指数関数的な成長のために、培養の最初の数時間に絶え間なく上昇します。
酸素摂取速度の短期的な低下は、基質が制限されたことを示し、微生物は代謝活性を低下させ、
一方、他の基質を代謝するように切り替えます。
次に指数関数的成長の別の段階が設定されます。
最高OURを伴う最大代謝活動の期間、および酸素制限による死の段階が設定され、
OURが急激に最小値まで低下する様子がグラフに示されています。
好気性成長中の酸素供給を予測するための新しい方法
SFR振とうフラスコリーダーを使用した測定により、k Lは使い捨て振とうフラスコでの培養条件の決定と信頼できる設計が可能になります。
溶存酸素(DO)は好気性培養中の重要なパラメーターであり、その低い溶解度により、特定の培養条件下では酸素が制限される可能性があります。この研究では、使い捨て振とうフラスコでの異なる培養条件下での酸素移動速度、酸素飽和度、最大細胞濃度を予測するための新しい方法が開発されました。したがって、充填体積、容器サイズ、および攪拌速度から体積気液物質移動係数(k L a)を決定するための新しい数学的な相関関係が確立されています。酸素測定は、SFR振とうフラスコリーダーを使用して行われました。C. glutamicumでの試験後この新しい方法により、培養条件の信頼できる設計を実現でき、制限なしで可能な最大細胞濃度を予測できることが示された。
振とうフラスコは、取り扱いが簡単、スループットが高いなど、いくつかの利点があるため、研究や産業で広く使用されています。これが、振とうフラスコ内の溶存酸素濃度と物質移動がいくつかの研究ですでに調査されている理由です。ただし、この情報は、実験計画の予備的な検討や好気性培養でのDOの予測に使用されたことはありませんが、酸素の制限により、大きな利点があり、失敗を防ぐことができます。この研究では、好気性成長中の酸素飽和度を信頼性高く予測する方法を開発しました。センサーが内蔵された使い捨て栽培容器の市場が拡大しているため、私たちの実験はこのタイプのプラスチック振とうフラスコに焦点を当てました。k Lについて体系的な調査を行いましたaバッフル付きとバッフルなしの使い捨て振とうフラスコで、SFR振とうフラスコリーダーを使用して酸素の監視を実現し、容器内のオンライン監視を可能にしました。k個の結果の数学的相関L計算は次いで、モデルの栽培に使用されているコリネバクテリウム・グルタミカム、および酸素制限なしに得ることができた最大細胞濃度は、予め決定されました。
材料と方法
k L aは、酸素およびpHセンサー(SFSセンサーフラスコ、PreSens社)が組み込まれた、異なるサイズ(125、250、500 mL)のバッフル付きおよびバッフルなしの振とうフラスコで定量化されました。測定は、100 mMリン酸緩衝液(pH 7.0)で、30および37°Cで、50 mmの振とう径のオービタルシェーカーで行いました。DOモニタリングは、SFR:Shake Flask Reader(PreSens社)で実現されました。振とうフラスコを緩衝液およびCo(NO 3)2(0.1 mM)で平衡化した。200 gL -1 Na 2 SO 3ストック溶液を添加することにより、完全な酸素枯渇が得られました。作業量(10〜40%最大充填量)と振とう頻度(50、150、250 rpm)を変え、すべての測定を3回繰り返しました。k LaはBerkley MADONNA(Ver。8.0.1)を使用して、20〜90%の酸素飽和度で測定されました。k L aの推定値については、実験データに基づいて、フラスコのサイズ、振盪頻度、およびk L aの間の経験的な相関関係をまとめました。数学的なフィッティングは、ガウス関数または放物線関数のいずれかを使用しました[1]。C.グルタミカム ATCC 13032は、ミネラル塩培地で培養した。培養物を250 mLバッフル付き振とうフラスコ(SFS、PreSens社)で30°C、150 rpm、10または30%の充填容量で培養しました。後者は、特定の成長率と特定の酸素摂取率を決定するために使用されました。成長と酸素摂取量のこれらの実験的に決定された値は、バイオマス濃度の増加と成長中のDOの減少を予測するために適用されましたC.グルタミカム 30°C、250 mL振とうフラスコで150 rpm、充填容量10%。
k L a振とうフラスコでの定量化
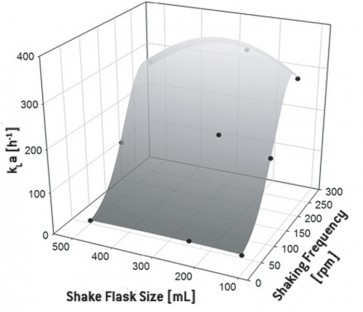
k L aは、緩衝液で満たされたバッフル付きおよび非バッフル付きの振とうフラスコでのオンライン酸素モニタリングによって決定されました。システムにNa2 SO3を加えることにより、酸素が完全に除去された。CO2+によって触媒されるレドックス反応が完了すると、フラスコ内の溶存酸素が増加し、これを使用して所定の条件のk L a を決定できます。調査した振とうフラスコでは、350 h -1までの非常に高いk L a値が測定されました。バッフルのない振とうフラスコの場合、k L aは一般に低く、k L a値100 h -1[1]。振動頻度は、酸素移動に最も大きな影響を与えました。容器のサイズは、バッフルなしの振とうフラスコのk L aに統計的に関連する影響はほとんどありませんでしたが、バッフル付きフラスコのk L aにはある程度の影響を示しました。30から37°Cへの温度上昇は、k L aにほとんど影響しません。それにもかかわらず、調査された充填量ごとに30および37°Cの個別の相関関係が確立されました。図2では、これは、30%で10%の充填量のバッフル付き振とうフラスコで示されています。バッフル付きフラスコのk L a値のガウスフィッティングおよび非バッフル付きフラスコのk L a値の放物線フィッティングの場合、最適なパラメーター推定が得られました。
図2:30°Cで充填容量10%のバッフル付き振とうフラスコのk L a、フラスコサイズ、振とう頻度の相関関係
C. glutamicumの増殖と酸素消費
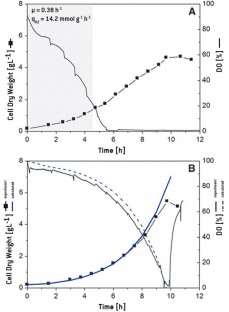
図3Aは、250 mL振とうフラスコでのC. glutamicum培養の30%充填容量と150 rpmの振とう頻度での増殖と酸素消費を示しています。DOは非常に速く低下し、4時間後には制限されたことがわかります。成長および酸素摂取量は、それぞれ0.38 h -1および14.2 mmol g -1 h -1と測定され ました。これらの値は、細胞増殖の時間経過と、これまでにテストされていない状態での別のC. glutamicum培養のDOを予測するために使用されました。計算は、10%の充填と150 rpmの振とう周波数を備えた250 mLバッフル付き振とうフラスコでの実験設定で行われました。k L aは190 h -1と計算されました接種濃度が0.2 g CDW L -1の場合、図3 Bに示すように細胞増殖の時間経過を決定しました(青色の実線)。すべてのパラメーターを考慮してDOが計算されました(青い破線)。実験を行い、培養性能をモニタリングすると、酸素消費量が実際に十分に予測されていることが確認できます。実験値と予測値はほぼ同じでした。酸素供給制限時の予想細胞濃度(4.3 g L -1)も、DOが20%のときに実験的に達成された4.6±0.3 g L -1の細胞濃度と一致しました。
図3:グルコースを唯一の炭素源とする無機塩培地におけるC. glutamicumの成長と酸素消費量。培養は、150rpmで30%の充填容量(A)と10%の充填容量(B)を備えた250mLのバッフル付き振とうフラスコで行われました。このセットアップ(灰色の領域)の非酸素制限相を使用して、比増殖速度µと比酸素取り込み速度q O2(A)を決定しました。予測値(青)と実験データ(黒)は優れた一致(B)を示しています。
結論
この研究の結果は、この方法が使い捨て振とうフラスコの最適な培養条件と酸素消費量を予測するために適用できることを明確に示しています。確立された相関k Lにより、計算はバッファーベースのシステムから標準的な振とうフラスコ培養に移すことができます。特定の実験設定の酸素利用可能性を予測する機能は、実験計画を大幅に改善できます。SFRシステムは、使い捨ての振とうフラスコ内の酸素モニタリング用に特別に設計されており、この調査で貴重なツールであることが判明し、この新しいメソッドの開発とその後の検証のための基本データを提供します。
SFRバリオによるS. cerevisiae文化のオンライン監視
新しいオンラインバイオマスデータはオフライン測定と非常によく一致しています
Saccharomyces cerevisiaeでモデルプロセスを調査するために、新しいSFRバリオシェークフラスコリーダーを使用して、2 Lシェークフラスコ内のO 2、OUR、pH、およびバイオマスをオンラインで監視しました。2回の初期実行と1回の最終モデル確認実行が実行されました。記録されたバイオマスデータは、線形キャリブレーションモデルを適用することにより、光学密度(OD)と関連付けられました。SFRバリオシステムで収集されたオンラインデータは、オフラインの測定値と比較されました。3つすべての実行で行われた記録は、オフライン測定とよく一致する同等のデータをもたらしました。SFRバリオは、取り扱いが簡単でサンプリングの必要がないため、培養モニタリングを強化します。さらに、文化パフォーマンスのより詳細なビューを提供します。
新しいSFRバリオは、振とうフラスコ内の酸素、pH、およびバイオマスのオンライン監視を可能にし、さらに自動酸素摂取率(OUR)計算を可能にします。このシステムはシェーカーインキュベーター内に直接設置され、Bluetoothを介してワイヤレスで制御されます。バイオマスは光学的に測定され、反射率の値は、実際の培養の前にテスト実行でキャリブレーションモデルを作成することにより、光学密度(OD)、細胞乾燥重量(CDW)、または細胞濃度に相関させることができます。このシステムは、下部に光学式酸素センサーとpHセンサーが組み込まれた振とうフラスコで使用されます。これらのセンサーは製造元によって事前に較正されており、提供されている較正ファイルはSFRバリオソフトウェアにインポートするだけです。S. cerevisiaeを使用したモデルプロセスでこのデバイスのパフォーマンスをテストしましたオンラインの結果を、従来のサンプリングおよび測定方法で収集したオフラインのpHおよびOD値と比較します。2つの初期実行と1つのモデル確認実行は、統合されたO 2とpHセンサーを備えた2 L振とうフラスコ内で、振とう直径1.0インチ、28°C、225 rpmで実行されました。
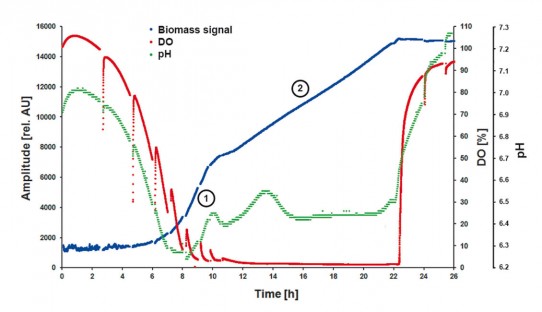
図1:例:4つの振とうフラスコ培養物内のO2、pH、OUR、およびバイオマスを同時に監視するための振とうインキュベーター内に設置された4つのSFR vario
酸素モニタリング&OUR
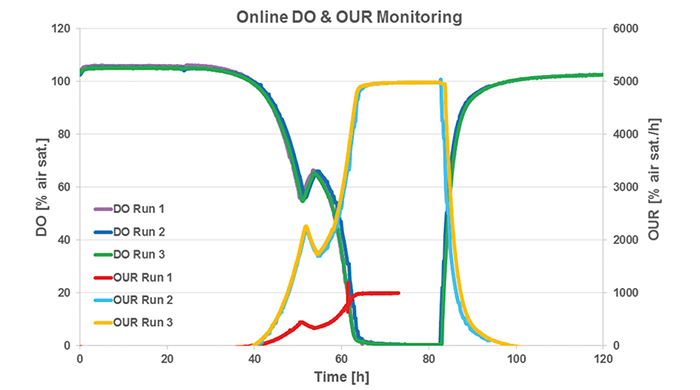
溶存酸素(DO)の含有量は、以前はこのモデルプロセスで追跡されていませんでした。SFR varioを使用したDO測定では、3つすべての栽培で同様のプロファイルが示されました(図2)。細胞の増殖により、培地内の酸素レベルが継続的に低下しました。ブドウ糖が枯渇すると、S。cerevisiaeは以前に生産されたエタノールを消費するように切り替わりました。この代謝シフトの間、酸素消費は減少します。これは、培養55時間での酸素測定値の小さなピークによって示されます。3つすべての実行で、約65時間後に酸素制限が設定されます。自動OUR計算では、実行を開始する前にソフトウェアにk L aを入力しました。ラン2および3のk L aは50でしたが、ラン1のk L a値は10と誤っていました。異常なk Lラン1のaは、ラン2および3と比較すると、OUR計算に不一致を引き起こしました(図2)。これらの2つの培養は、酸素制限に達するまでOURを増加させながら、同様のプロファイルを再度示しました。基質の変化は、OURの小さなドロップでも示されました。酸素測定とSFR varioを使用したOUR計算により、3つの培養ランすべてで一貫した結果が得られました。ただし、間違ったk L a値によって発生したラン1のOURは例外です。
図2:S. cerevisiae培養の3回の実行(2 L振とうフラスコ)でのオンラインDO測定と自動的に計算されたOUR :相変化がはっきりと見えるだけでなく、約55時間の培養で代謝シフト中の酸素消費量が減少します。酸素制限は約65時間後に達します。実行1でのOURの異常なグラフは、ソフトウェアに誤ったk L aを入力したことが原因です。
pH測定
オンラインで測定したSFR varioデータと比較するために、オフラインのpH測定を行いました。光学素子の上にフラスコが正しく配置されていないため、センサーの読み取りと、それに伴うpH 1のオンライン監視が適切に機能しませんでした。一方、他の2つの分析では、同様のpHプロファイルが得られました(図3)。測定されたpHと既知の開始pHの大幅なオフセットの場合、SFR varioソフトウェアは、pHの1点調整機能、1点校正を提供し、以降のすべての測定を調整します。この機能はこれらの実験では使用されておらず、オフラインとオンラインの測定データは一致していることがわかりました。これは、振とうフラスコに組み込まれたpHセンサーの事前校正が正確であることを証明します。ラン2と3のオンライン測定値は、オフライン測定結果よりも相関性が高かった。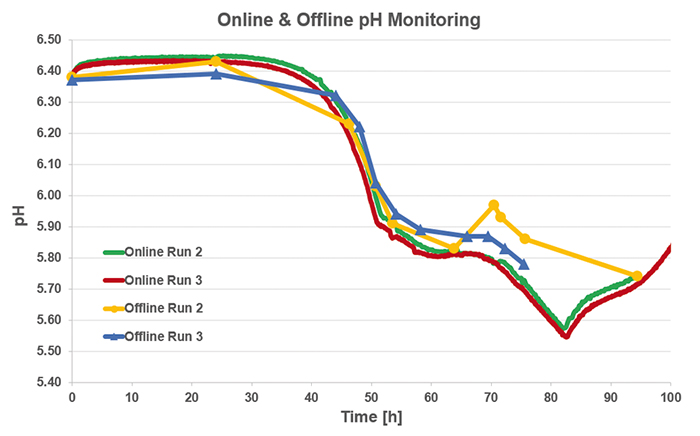
図3:オフラインで測定されたpH値と比較したS. cerevisiae培養液(2 L振とうフラスコ)の2回の実行におけるSFRバリオによるオンラインpHモニタリング:オンラインとオフラインのデータは相関しています。
バイオマスおよびODモニタリング
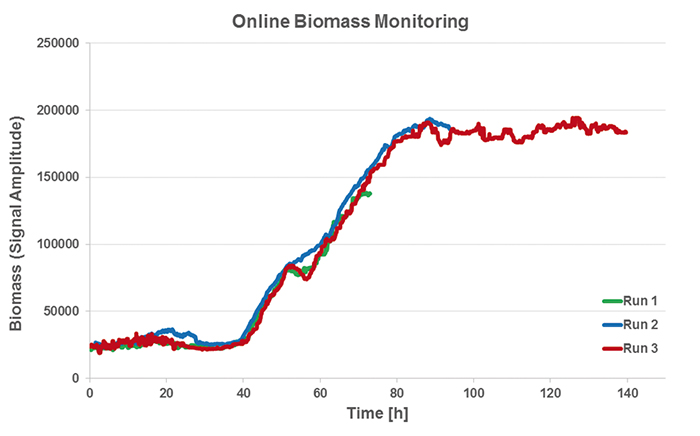
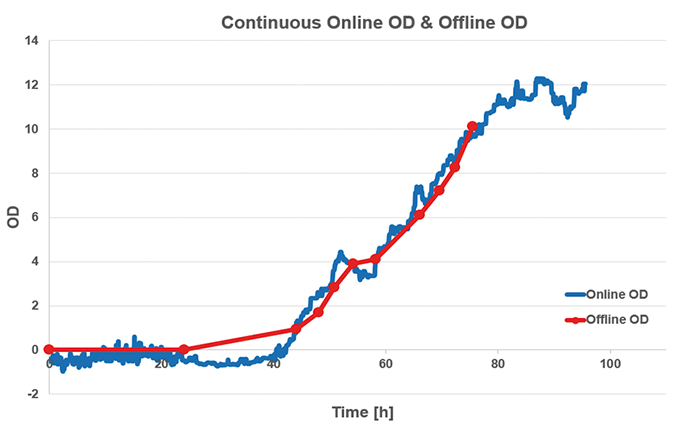
SFR varioを使用してバイオマス反射率の値を記録し、オンラインでの結果との相関関係についてオフラインOD測定を行うために試運転を行いました。バイオマスデータは、3つの実行すべてで同等の傾向を示しました(図4)。バイオマス測定値の角度オフセットを調整するオプションにより、信号対雑音比が低下し、測定分解能が向上する可能性があります。オンライン測定データは再び55 hあたりに小さなピークを示し、別の基質の消費への代謝シフトが起こり、成長は一時的に停滞しました(酸素測定でも確認できます)。式y = a * x-bの線形モデルを使用して、ODを反射率値と相関させ、より多くのデータを取得し、測定角度をさらに改善しました。
図4:S. cerevisiae(2 L振とうフラスコ)の3回の実行におけるSFR varioを使用したオンラインバイオマス測定:約55時間の培養で起こる代謝シフトは、グラフの成長として小さなキンクまたはプラトーとして見ることができます一時的に停滞した。
図5:オフラインOD測定と比較したS. cereivisaeの 2つの並行培養(実行3、2 L振とうフラスコ)でのSFR varioによるオンラインOD測定:線形モデルがSFR varioバイオマスキャリブレーションと光信号振幅値の相関に使用されました光学濃度; オンラインとオフラインのデータは良好に一致しており、55時間での成長の低下を引き起こす代謝シフトは、オンライン測定でより明確に確認できます。
結論
S. cerevisiaeを使用したモデルプロセスでのSFR varioの実験このデバイスは、従来のオフライン測定と一致する正確なデータを提供することを実証しました。以前は追跡されていなかったパラメーターを継続的に記録することができ、その結果、さまざまな段階での培養性能のより詳細なビューが得られました。1台のデバイスで複数のパラメーターをオンラインで監視することにより、最小限の作業で再現可能なデータを提供します。バイオマス相関のキャリブレーションモデルが構築されると、すばやく簡単に生成され、それ以上のサンプリングは必要ありません。汚染のリスクが最小限に抑えられます。正確な培養条件に関する情報はデータファイルに保存され、後で分析中に参照できるため、温度と攪拌の追跡が非常に便利です。SFR varioは、培養性能モニタリングのための優れたツールであることが証明されました。
食品メーカー
・イースト菌の培養効率改善へ向けた 酸素, pH,濁度のモニタリング
機能性食品
・新規有用酵素, 生産物, 菌種のスクリーニングのための培養時の 酸素, pH,濁度のモニタリング